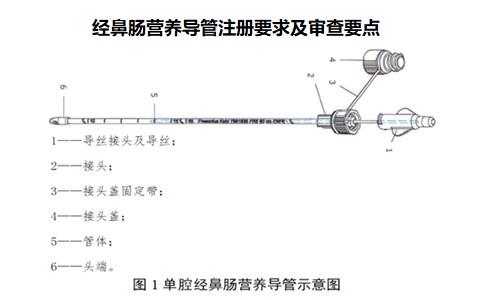
經鼻腸營養(yǎng)導管注冊產品可采用TPU����、聚氯乙烯�、硅橡膠等材料制成,目前已上市產品常用材料為TPU����。通常由頭端、管體�、接頭、接頭蓋、導絲等組成�����。根據產品結構可分為單腔�、雙腔、三腔等�����,頭端可有直插型��、螺旋型����、重力型��、球囊等不同設計�;接口有扣蓋,有利于保持清潔���;外壁帶有數字刻度����,可有效指示產品在體內的使用長度;管壁使用射線可探測材料�,具有顯影定位功能。
經鼻腸營養(yǎng)導管注冊產品可采用TPU�、聚氯乙烯、硅橡膠等材料制成�,目前已上市產品常用材料為TPU。通常由頭端���、管體��、接頭����、接頭蓋�、導絲等組成。根據產品結構可分為單腔��、雙腔����、三腔等,頭端可有直插型���、螺旋型����、重力型、球囊等不同設計���;接口有扣蓋��,有利于保持清潔���;外壁帶有數字刻度,可有效指示產品在體內的使用長度���;管壁使用射線可探測材料,具有顯影定位功能��。
經鼻腸營養(yǎng)導管通常由鼻腔經食道插入胃���,在胃腸蠕動的推動下滑移進入十二指腸或空腸內���,或借助胃鏡/十二指腸鏡輔助插入十二指腸或空腸,并經X射線顯影等方式確定置管位置�,與相關給營養(yǎng)器械配合,用于向胃腸道引入營養(yǎng)液等�,部分多腔鼻腸管還可用于胃部沖洗等。
1.經鼻腸營養(yǎng)導管注冊產品的適用范圍、禁忌證
1.1適用范圍
醫(yī)療器械注冊申請人應當明確產品的適用范圍�����,其描述應與申報產品的性能�����、功能相符��,并應與臨床評價資料結論一致��。如:用于經鼻向胃腸道引入營養(yǎng)液等���。部分可實現沖洗等其他輔助功能�����。
1.2預期使用環(huán)境
明確該產品預期使用的地點�����,如醫(yī)療機構等���?�?赡苡绊懫浒踩院陀行缘沫h(huán)境條件�����,如溫度���、濕度、壓力��、海拔等���。1.3適用人群
適用人群建議說明目標患者人群信息��,患者選擇標準���,重要考慮因素等�����。
1.4禁忌證:產品材料有過敏史者��,食道下段靜脈曲張患者�����、食道出血患者、食道梗阻患者���、腸道吸收障礙患者等其他不宜采用經鼻腸營養(yǎng)管飼的患者�����。
2.經鼻腸營養(yǎng)導管注冊產品技術要求及檢驗報告
2.1經鼻腸營養(yǎng)導管注冊產品技術要求
應當按照《醫(yī)療器械產品技術要求編寫指導原則》的規(guī)定編制產品技術要求���,技術指標引用標準應當為現行有效版本。
經鼻腸營養(yǎng)導管基本技術性能指標包括但不限于以下內容�,申請人可根據產品自身特點,參考相應的國家�����、行業(yè)標準制定產品技術要求�����,如有不適用條款(包括國家標準�����、行業(yè)標準要求),申請人應在申報資料中說明理由���。
2.1.1外觀 :經鼻腸營養(yǎng)導管應清潔����、無異物���,不應有表面缺陷和加工缺陷��;導絲頭端應圓鈍�。
2.1.2尺寸:外徑��、內徑����、長度及允差等。
應給出產品的示意圖��。
2.1.3連接件(拉伸性能�����、液體泄漏)
應符合YY 0483要求�����。
2.1.4拉伸性能:應符合YY 0483要求��。
2.1.5管身刻度的要求���。
2.1.6抗彎曲性能�。
2.1.7配合性能�����。
2.1.8耐腐蝕性(若適用)��。
2.1.9化學性能���。
根據不同材料特性�,由企業(yè)決定具體的化學性能要求(如:酸堿度��、紫外吸光度��、還原物質����、蒸發(fā)殘渣�����、重金屬��、過氧化物等���,具體指標的選擇可以參照相應的國家、行業(yè)標準及已上市同類產品情況)���。用環(huán)氧乙烷滅菌的產品應規(guī)定環(huán)氧乙烷殘留量的要求�。
2.1.10射線可探測性(也可使用其他定位方式����,如:電磁導航等)。
2.1.11產品應無菌�。
2.1.12根據產品宣稱的技術特點制定的其他性能要求。
耐壓性(若適用)�;
涂層(若適用):摩擦力等;
帶球囊的產品應符合YY/T 0817要求�����。
2.2經鼻腸營養(yǎng)導管注冊產品檢驗報告
提供檢驗樣品型號/規(guī)格的選擇依據����。所檢驗型號/規(guī)格需為能夠代表本注冊單元內其他型號/規(guī)格的典型產品。當申報產品包括多個型號規(guī)格�,需綜合考慮經鼻腸營養(yǎng)導管的原材料、結構組成��、包裝方式���、滅菌方式�、生產工藝和預期用途等影響因素��。一個型號不能完全覆蓋時���,應選擇其他型號進行相關性能的補充性檢測����。注意典型型號/規(guī)格不一定是臨床常用型號/規(guī)格�����。